Química Orgánica Industrial
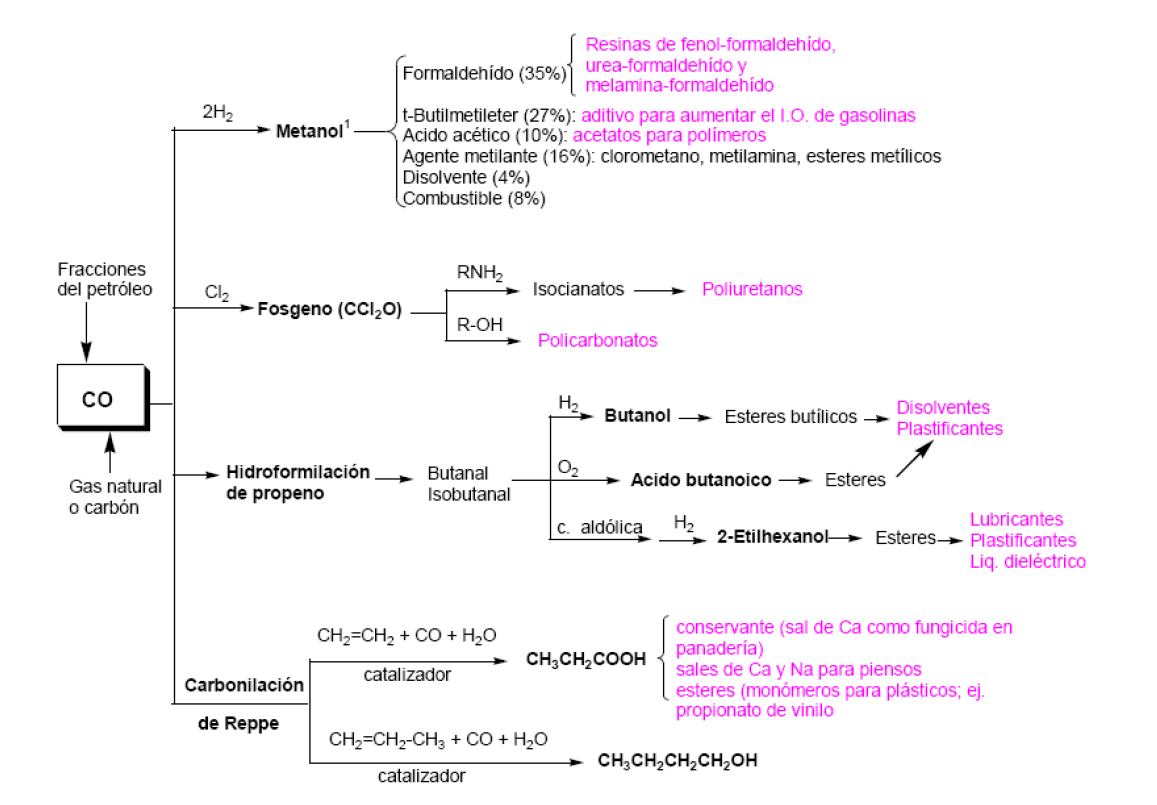
Utilización del monóxido de carbono en la industria
Autor: Ascensión Sanz Tejedor
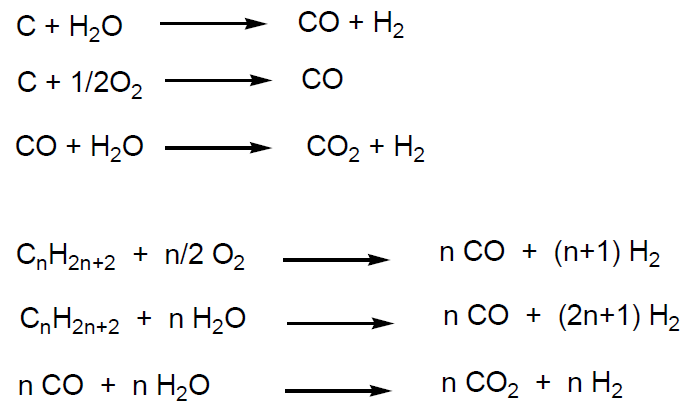
El monóxido de carbono sólo (CO) o mezclado con hidrógeno es una materia prima económica y de gran utilidad para la industria química. Se obtiene por combustión del carbón, gas natural o hidrocarburos procedentes del petróleo.
Junto a su empleo en la síntesis de productos valiosos tales como:
- Metanol (gas de síntesis) para formaldehído y ácido acético.
- Fosgeno
- Ácido acrílico o propenoico por carbonización de acetileno (C2H2 + CO + H2O; esta reacción ha perdido importancia industrial por el alto coste del acetileno)
También se emplea en procesos generales como:
- Hidroformilación
- Carbonilación (proceso Reppe; ácido propiónico y butanol)
- Reacción de Koch
1.- Conversión, rendimiento y selectividad de los procesos químicos.
La conversión de un componente en una reacción química de la forma:
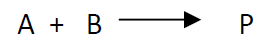
se define como el cociente entre la cantidad transformada y la cantidad inicial empleada.
Ahora bien dicha reacción puede estar acompañada de reacciones concurrentes tales como:
- reacciones paralelas
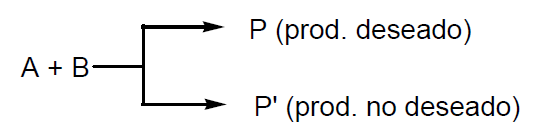
- reacciones secundarias
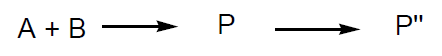
Se entiende por selectividad en un producto de reacción (P) al cociente entre la cantidad de producto formado [P] y la cantidad efectiva transformada de uno de los componentes empleados [Atransf].
Se entiende por rendimiento de un producto de reacción (P) al cociente entre la cantidad [P] obtenida de dicho producto y la cantidad empleada del sustrato inicial [Ao]
Ejemplo. Dada la reacción:
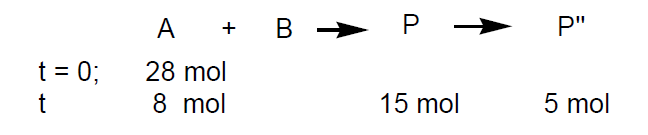
La conversión será: (28-8/28)x100 = 71,4 %
La selectividad será: (15/20)x100 = 75 %
El rendimiento: Rto. = (15/28)x100 = 53,57 %; Rto. = Conversión x Selectividad
2.- Preparación industrial de metanol.
El metanol es un líquido incoloro de Tb = 64,7 °C, Tf = -97,8 °C y densidad 0,781 g/cc. Es muy tóxico, incluso por inhalación, porque en el organismo se metaboliza a ácido metanoico (fórmico) que ataca la retina y, en pequeñas cantidades, produce ceguera.
El metanol es una de las sustancias para síntesis más baratas y que en mayor cantidad se obtienen. La producción mundial de metanol es de aproximadamente 40x106 Tm de las cuales el 90% es utilizado por la industria química y el resto para obtener energía.
El metanol se obtiene a partir de gas de síntesis siendo la proporción molar adecuada CO:H2, 1:2.
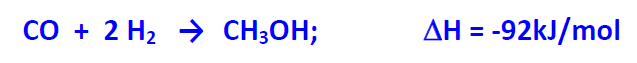
A) En el proceso BASF (35% de la producción) se trabaja a 320-380 ºC y a presiones muy elevadas de 340 atm con un catalizador de Cr2O3-ZnO. La reacción es exotérmica y necesita refrigeración; los gases que salen del reactor se enfrían para condensar el metanol formado, y los no condensados se reciclan. Con un solo paso por el reactor se consigue una conversión en torno al 15%, por lo que se utilizan varios reactores.
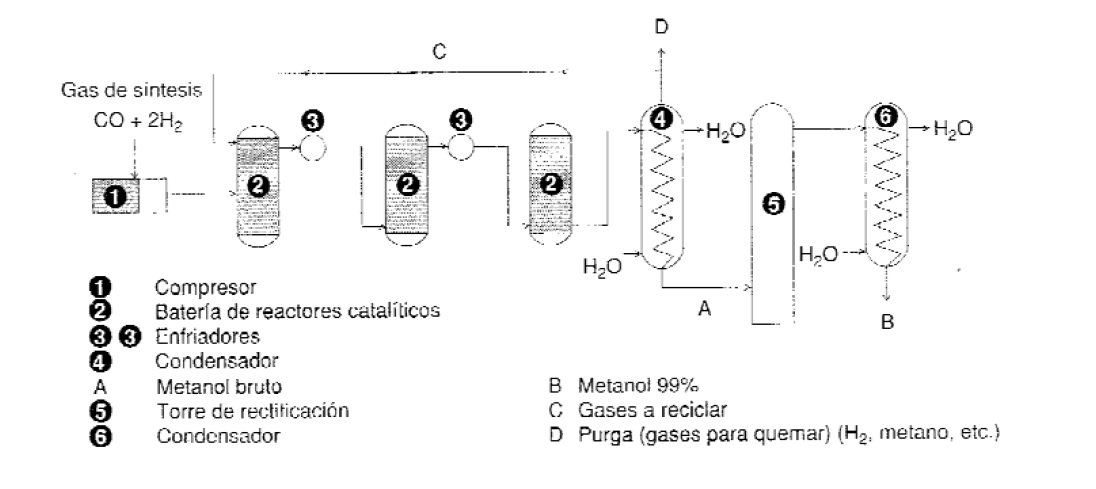
El metanol se purifica por destilación fraccionada, para separar los subproductos, y se obtiene con un 99% de pureza.
La tendencia actual es trabajar a presiones bajas o moderadas utilizando nuevos catalizadores.
B) Así, en el proceso ICI (el 65% del metanol producido está basado en el proceso ICI) se utilizan catalizadores que son más activos, generalmente CuO junto con otros óxidos de Zn o Al (CuO/Al2O3) que permiten llevar a cabo el proceso a presiones entre 50 y 100 atm y temperaturas de unos 250 ºC según el catalizador empleado. El metanol obtenido tiene una pureza mayor del 99,99 % en peso. El proceso requiere un CO muy puro, libre de compuestos de azufre (<1ppm para evitar la inhibición del catalizador).
En la Tabla se indican las aplicaciones del metanol. Actualmente el derivado que se obtiene en mayor proporción es el formaldehído, que se emplea sobre todo (aproximadamente el 50%) para la fabricación de resinas fenol-formaldehído, urea-formaldehído y melamina-formaldehído. A partir de metanol se pueden obtener otros compuestos de interés como ácido acético, halometanos, terbutil metil éter, tereftalato de dimetilo, metilaminas y metacrilato de metilo, si bien la preparación de todos ellos se realiza preferentemente por otros procedimientos.
| Mundo | |
| Formaldehído | 35 |
| ter butil metil éter1 | 27 |
| Ácido acético | 10 |
| Halometanos2 | 7 |
| Terftalato de dimetilo2 | 2 |
| Metilaminas2 | 4 |
| Metacrilato de metilo2 | 3 |
| Disolventes | 4 |
| Otros3 | 8 |
| Uso total (en 106 Tm) | 40 |
| 1. Utilizado para aumentar el índice de octanos de las gasolinas 2. Agente metilante 3. Uso como combustible |
|
Hay que tener en cuenta que el metanol tiene otros campos posibles de aplicación que se harán realidad en un futuro no muy lejano. Si tenemos en cuenta el cambio previsible de precios para los productos derivados del petróleo, el aumento del consumo de energía unido a las limitadas reservas de petróleo y gas natural y el crecimiento de la población, el metanol puede llegar a ser un producto clave. Así el metanol puede ser materia prima para diversas síntesis, combustible, componente para gasolinas así como base para la obtención de proteinas. Para ello está previsto instalar factorías de metanol en las proximidades de los pozos petrolíferos, con una capacidad de producción de 10x106 Tm, con objeto de aprovechar el gas de petróleo que flamea de los mismos.
El metanol puede utilizarse mezclado con gasolina (15% en volumen) en los motores convencionales. Incluso utilizando metanol puro sólo habría que realizar pequeños cambios en el carburador, en el precalentado de la mezcla, así como un mayor volumen del depósito ya que la (H(vapor) del metanol es tres veces superior y su contenido energético aproximadamente el 50% frente a la gasolina. Como ventajas presenta una mayor resistencia al picado del motor debido a su mayor índice de octano (> 100) y disminución de sustancias tóxicas en los gases de escape.
2.1.- Preparación de formaldehído a partir de metanol.
Es un gas a temperatura ambiente de Tb = -21 ºC. La producción mundial de formaldehído está en torno a 7,5x103 Tm.
Prácticamente todo el formaldehído se obtiene a partir de metanol. La preparación industrial se realiza por dos tipos de procesos:
- Deshidrogenación catalítica de metanol con catalizadores de Ag metálicos. Se adiciona una cantidad de aire inferior a la estequiométrica (para evitar explosiones) para oxidar el hidrógeno resultante a agua.
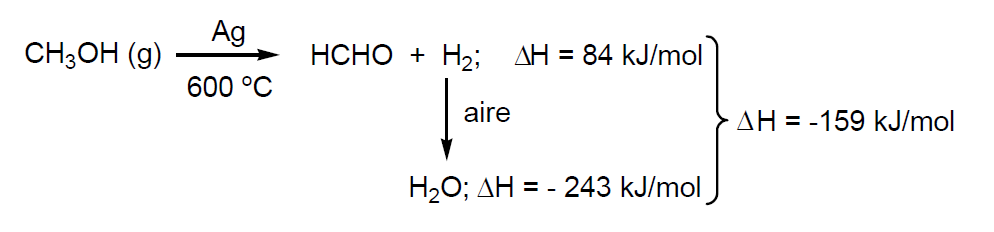
Los gases calientes así obtenidos, se enfrían a unos 100 °C y se pasan por agua hasta tener una disolución de formaldehído del 37-42%. La disolución se estabiliza por adición de metanol, ya que pequeñas cantidades de metanol (1-2% en peso) evitan su polimerización. El rendimiento del proceso es del 92 % con una selectividad superior al 98%. La vida media del catalizador es de 2 a 4 meses pero se regenera por electrolisis.
- Oxidación de metanol con exceso de aire y catalizadores que son óxidos de Fe y Wolframio (MoO3-Fe2O3). Se introduce una corriente de metanol con un gran exceso de aire a 400 °C en un reactor tubular que contiene el catalizador.
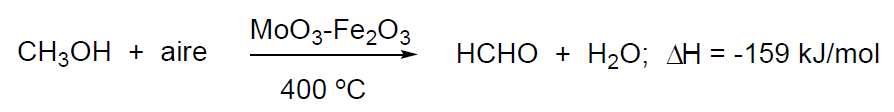
La vida del catalizador es de unos dos años. El proceso necesita refrigeración, y para ello se utiliza un reactor tubular que lleva una envolvente con un líquido refrigerante. El formaldehído gaseoso, así obtenido, se enfría a 100 °C y se trata con agua hasta obtener una disolución del 37-50% en peso de formaldehído. La conversión es próxima al 99% y la selectividad alcanza el 94%.
El formaldehído es un gas incoloro que se polimeriza rápidamente en presencia de pequeñas cantidades de agua o de impurezas. Hay tres formas comerciales de presentación:
- disolución acuosa al 30% en el cual se encuentra como hidrato o mezcla de oligómeros.
- en forma trímera, denominada trioxano
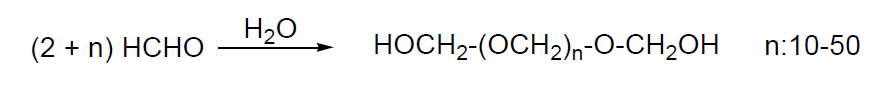
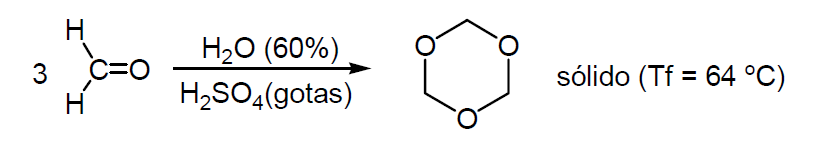
En disolución de HCl se despolimeriza.
Los principales usos del formaldehído son:
- como desinfectante y conservante en las industrias textil, pieles, cuero, papel y madera,
- para resinas urea-formaldehído (33%), fenol-formaldehído (11%), y melamina-formaldehído (4%), y
- para polímeros de polioximetileno, POM (40%). Se obtiene por polimerización de formaldehído en condiciones anhidras, en un disolvente inerte y en frío.
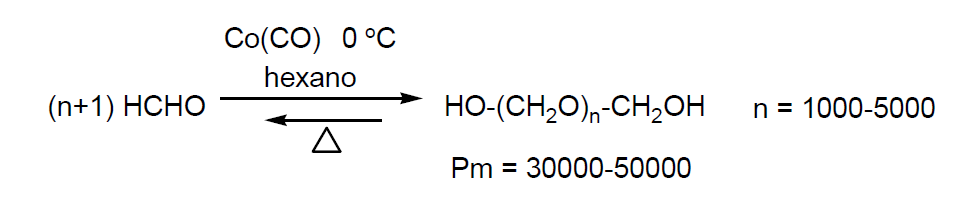
Para evitar la despolimerización los grupos hidroxilo terminales se esterifican.
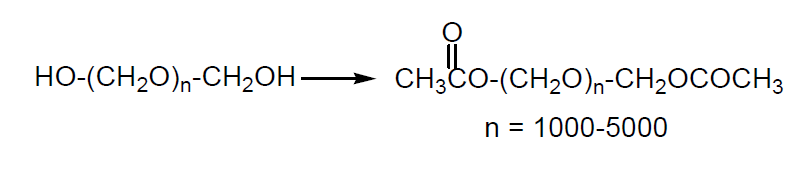
El polímero resultante es un polvo blanco denominado delrín o celcón. Se trata de un plástico tenaz, duro, resistente a la abrasión, al agua y a los disolventes orgánicos y que presenta un bajo coeficiente de fricción con el acero. Se emplea en piezas de automóviles, maquinaria, utensilios, fontanería y cubiertas de aparatos eléctricos entre otros usos.
2.2.- Preparación industrial de ácido acético a partir de metanol.
El ácido acético es el ácido carboxílico de mayor importancia industrial. Es un líquido tóxico e inflamable (Tb = 118 ºC; Tf = 16,8 ºC; d = 1,07 g/cc) Su producción mundial es de 8,3x106 Tm. Los diferentes procedimientos de obtención quedan resumidos en el siguiente esquema:
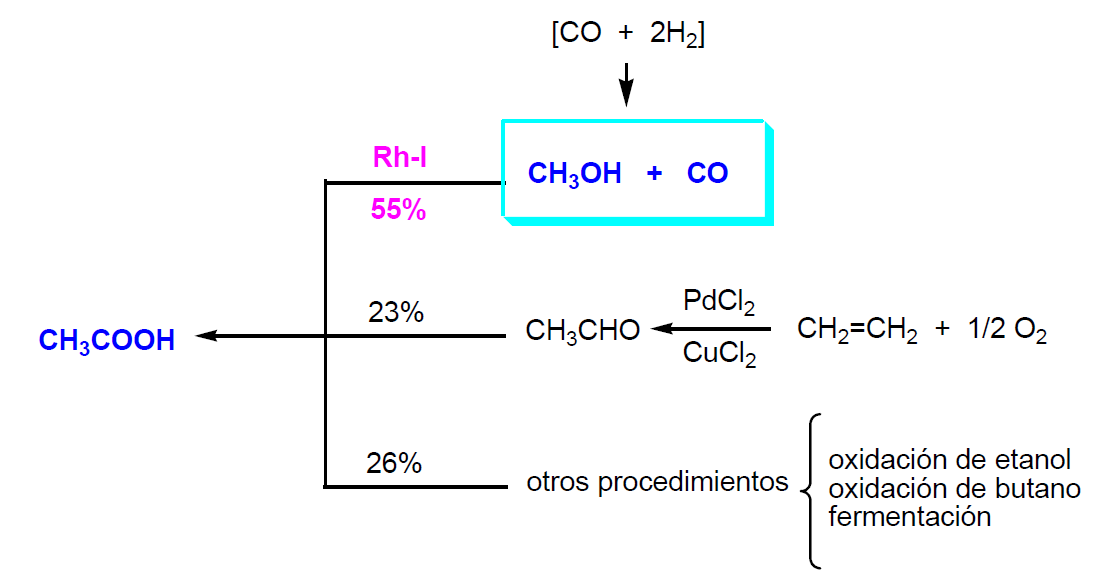
Aproximadamente el 55% del ácido acético obtenido a escala industrial es por carbonilación de metanol. El resto se obtiene por oxidación de etileno, oxidación de etanal (obtenido desde etileno) y en menor proporción por oxidación de butano y etanol. También se puede obtener por fermentación de residuos agrícolas. Europa y USA son los principales países productores de acético.
En el proceso Monsanto (1960) se utiliza un catalizador de Rh-I (rodio-yodo) y se trabaja en fase líquida (P = 30 atm; T = 150-200 ºC). El reactor así como el resto de las instalaciones son de una aleación de Mo-Ni para evitar la corrosión. En el proceso industrial el metanol y el CO reaccionan continuamente. La selectividad del acético respecto del metanol es del 99%. Los subproductos del proceso son CO2 e H2. La recuperación del catalizador es muy importante porque el Rh es muy caro.
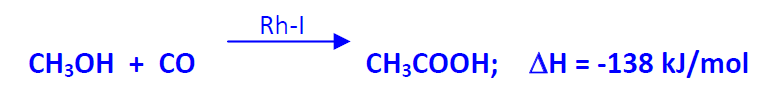
El ácido acético obtenido se purifica por destilación fraccionada y se obtiene con una pureza del 99,8%.
El uso principal del ácido acético es para la obtención de diferentes esteres acéticos que se utilizan como monómeros de plásticos vinílicos. El de mayor producción es el acetato de vinilo para la preparación de poliacetato de vinilo (pinturas al agua), seguido del anhídrido acéetico para acetato de celulosa y aspirina entre otros. Los acetatos de butilo e isopropilo se usan como disolventes de pinturas y resinas .Los acetatos de sodio, plomo, aluminio y cinc se utilizan como auxiliares en la industria textil y de cuero, en tintorería y medicina. El ácido cloroacético es un producto intermedio para colorantes y productos farmacéuticos y se usa para obtener el espesante carboximetilcelulosa (estabilizante de dispersiones).
| Mundo | |
| Acetato de vinilo | 49 |
| Anhídrido acético y derivados1 | 23 |
| Acetato de butilo y de isopropilo | 11 |
| Disolvente2 | 9 |
| Ácido cloroacético (ClCH2COOH) | 3 |
| Otros (acetatos metálicos; acetato de etilo3) | 4 |
| Uso total (en 106 Tm) | 8,3 |
|
1agente acetilante (ejemplo: síntesis de la aspirina y acetato de celulosa) 2disolvente para la obtención de ácido tereftálico y su éster dimetílico 3disolvente para pinturas y barnices |
|
3.-Producción de fosgeno desde monóxido de carbono.
El haluro del ácido carbónico es el fosgéno o cloruro de carbonilo. Es un gas muy tóxico e irritante que se utilizó en la primera guerra mundial como arma química. Su Tb = 8 ºC. Se expende envasado a presión en botellas de acero.
Se obtiene a partir de óxido de carbono y cloro y se comercializa en botellas de acero a presión.
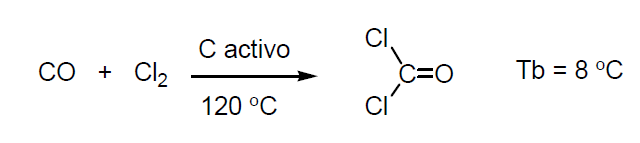
El fosgeno es materia prima para la fabricación de:
- policarbonatos
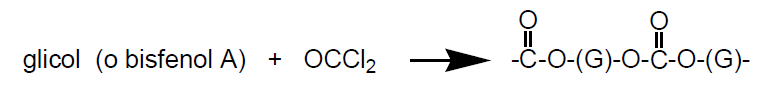
Los policarbonatos son plásticos de ingenieria transparentes, con buenas propiedades eléctricas, resistentes al impacto, no se ablandan hasta los 140 (C y su densidad es la mitad del vidrio (vidrios resistentes al impacto).
- ácido isociánico que es la base de los poliuretanos
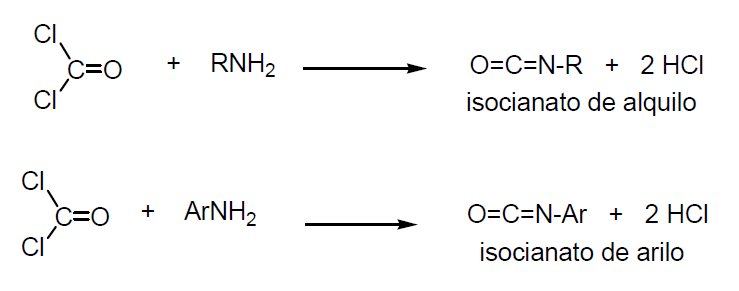
Los poliuretanos se usan como adhesivos, pinturas para aviones, fibras elásticas (trajes de baño), piezas elásticas para máquinas, recubrimientos de cables y para poliuretano expandido.
4.- Hidroformilación de olefinas (síntesis oxo).
La producción mundial de productos de hidroformilación asciende a 9,3x106 Tm/año. La hidroformilación o síntesis oxo es un proceso empleado en la industria para obtener aldehídos a partir de olefinas, monóxido de carbono e hidrógeno. Desde su descubrimiento en 1938 la hidroformilación se ha expandido enormemente hasta llegar a ser un proceso industrial para la fabricación de alcoholes C4-C8 (incluso C11) y alcoholes detergentes con longitudes de cadena de C12 hasta C14 (o C18).
La hidroformilación se puede realizar con un gran número de alquenos de cadena lineal o ramificada (C2 hasta C20) con enlaces dobles terminales o internos, si bien el alqueno más importante utilizado como producto de partida es el propeno. La reacción produce mezclas de aldehídos isómeros ya que el CO puede unirse a cualquiera de los carbonos del doble enlace.
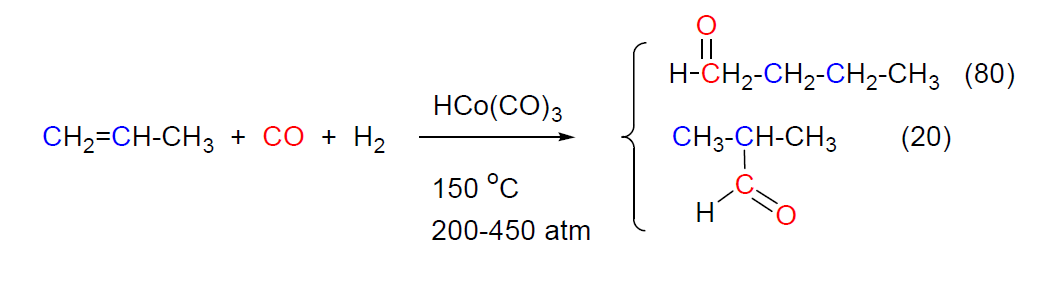
ΔH = -147 KJ/mol (enfriador tubular)
En la mezcla de isómeros predomina el isómero terminal, por ser este el menos impedido estéricamente. En el caso del propeno la relación butanal:isobutanal es de 80:20 aproximadamente.
El proceso requiere elevadas temperaturas (100-200 ºC) y presiones (200-400 atm) y la presencia de un catalizador. Como catalizadores se usan combinaciones de Co, Rh o Ru, cuya actividad y selectividad se pueden modificar con derivados de fósforo. En los procesos industriales se usan preferentemente compuestos de Co que son más baratos y tienen gran actividad si bien los catalizadores de Rh modificados con compuestos de fósforo dan lugar a la mejor proporción de aldehído terminal (94:6 respecto de 80:20 obtenida con catalizadores de Co no modificados).
En el proceso industrial el Co se introduce en el reactor de alta presión de acero inoxidable, como polvo metálico, hidróxido o sal. En estas condiciones de reacción el Co se transforma en hidruro de cobaltotricarbonilo H-Co(CO)3 que se adiciona al doble enlace como electrófilo. El calor de reacción (147 kJ/mol) se elimina por refrigeración (enfriador tubular).
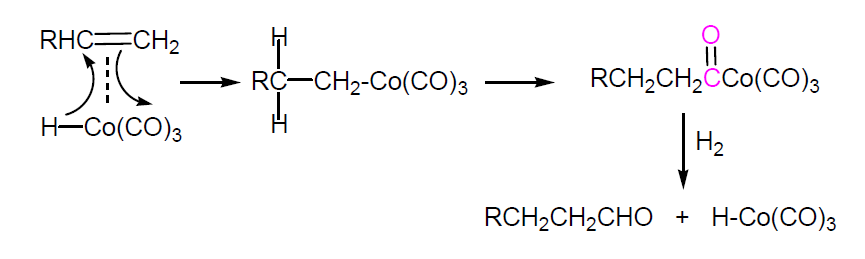
A la salida del reactor se disminuye la presión hasta 20 atm. Precipita así un barro de Co que se filtra y se regenera para su uso posterior. Los productos de reacción, libres ya del catalizador, se purifican por destilación fraccionada.
La conversión es del 90 % y la selectividad en productos C4 está en torno al 85 % (respecto del propeno).
5.- Aplicación de los productos de hidroformilación.
Los productos primarios obtenidos en la hidroformilación son aldehídos de ahí el nombre de productos oxo. Los aldehídos, no obstante, como producto final no tienen aplicación. Su interés se debe a que son productos intermedios valiosos en la preparación de alcoholes, ácidos carboxílicos y productos de condensación aldólica.
5.1.- Alcoholes oxo.
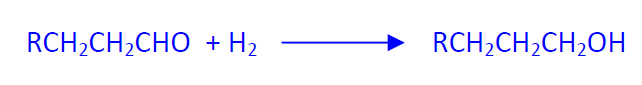
El grupo de alcoholes oxo incluye los productos de hidrogenación directa de los aldehídos oxo, así como los productos de condensación aldólica. Se emplean los aldehídos libres de catalizador. La producción mundial de alcoholes oxo es de aproximadamente 6,1x106 Tm.
Los alcoholes se obtienen por hidrogenación catalítica según dos variantes:
- en fase gas con catalizadores de Ni (115 ºC; 2-3 atm) o Cu (130-160 ºC; 30-50 atm),
- en fase líquida utilizando Ni como catalizador a 115 ºC y 80 atm. Sólo si se utilizan los productos brutos que además de aldehídos contienen ácidos y esteres.
El alcohol oxo cuantitativamente más importante es el n-butanol cuya producción, en los principales países industrializados, USA, Europa Occidental y Japón, alcanza los valores de 842x103, 690x103 y 240x103 Tm respectivamente. El butanol se utiliza directamente o esterificado con ácidos carboxílicos (acético para dar acetato de butilo, butanoico, láctico,...) como disolvente para grasas, aceites, ceras, resinas naturales y plásticos sintéticos. En general, los alcoholes oxo de longitud C4-C6 se pueden utilizar directamente, o tras su transformación en esteres, como disolventes para la industria de las pinturas y de los plásticos.
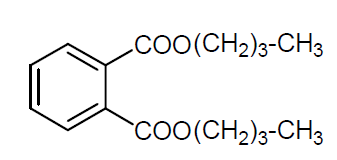
Los alcoholes oxo de longitud C6-C11 se emplean esterificados por ácidos dicarboxílicos o sus anhídridos como plastificantes. Uno de los más importantes es el ftalato de dibutilo que se emplea como plastificante para PVC.
Los alcoholes C12-C18 tras su transformación en sulfatos se utilizan como materia prima en la fabricación de tensoactivos (detergentes) o como producto auxiliar en la industria textil.
5.2.- Ácidos carboxílicos oxo.
Los aldehídos se pueden transformar en ácidos carboxílicos utilizando aire como oxidante en presencia de catalizadores metálicos, o en ausencia de los mismos a una temperatura de unos 100 ºC y a 7 atm. Como catalizadores se emplean metales capaces de cambiar de valencia como Cu, Fe, Co o Mn entre otros.

La mayoría de los ácidos así obtenidos se transforman en esteres que se emplean, preferentemente, como disolventes y plastificantes. Comonómeros para la fabricación de resinas de poliester (resinas alquídicas) por polimerización con etilénglicol. Las sales de Cobalto, Manganeso, Plomo, Cinc y Calcio sirven como aceleradores de secado para pinturas (sales del ácido isooctánico, ac. 2-metilheptanoico)
5.3.- Productos de condensación aldólica.
Una aplicación importante de los aldehídos oxo es su transformación en los correspondientes productos de condensación aldólica. En este sentido uno de los productos más importantes es el 2-etilhexanol que se obtiene por condensación aldólica del butanal, y posterior hidrogenación del producto aldólico. El proceso industrial se realiza en medio básico de hidróxido de sodio a 80-100 ºC. La posterior hidrogenación se lleva a cabo a presión (5 atm) en presencia de Ni como catalizador. La selectividad del proceso es del 95%.
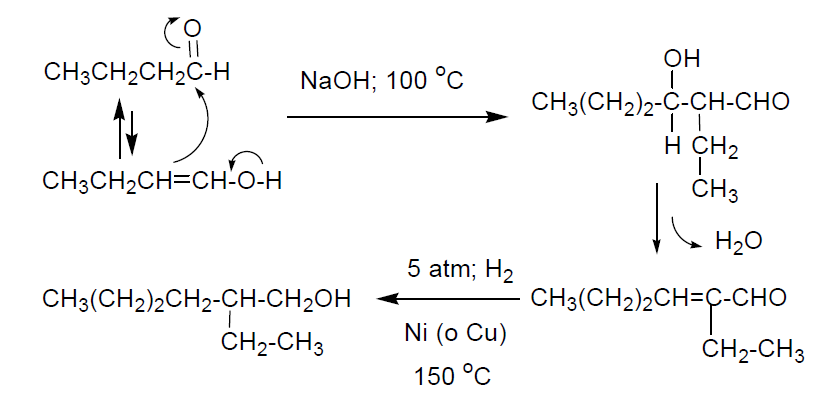
La producción mundial de 2-etilhexanol es de unas 2,8x106 Tm y se usa, sobre todo, para la obtención de esteres con ácidos dicarboxílicos, como el ftálico y el adípico (hexanodioico). El producto que se obtiene por reacción del 2-etilhexanol con el anhídrido ftálico es un excelente plastificante por sus propiedades particulares: no es tóxico, poco volátil, estable al frío, al calor y al agua. Se usa para plastificar piezas que deban mantenerse a temperaturas superiores a las normales, como piezas de aparatos eléctricos. También se utiliza como líquido dieléctrico para condensadores. Los ésteres derivados del 2-etilhexanol con ácidos dicarboxílicos alifáticos como el ácido adípico (1,6-hexanodioico) se emplean como aceites hidráulicos o como componentes de lubricantes sintéticos.
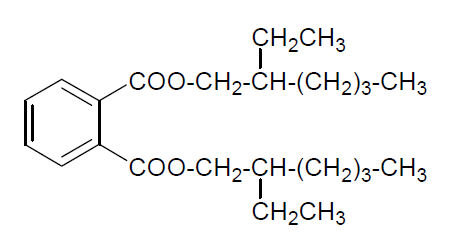
6.- Carbonilación de olefinas (reacciones de Reppe).
La reacción de olefinas con CO y reactivos nucleófilos, tales como agua, alcoholes, aminas, ácidos carboxílicos o tioles, en presencia de catalizadores metálicos, permite obtener ácidos carboxílicos y sus derivados (ésteres, tioésteres, amidas, anhídridos..). El proceso recibe el nombre de reacción de Reppe.
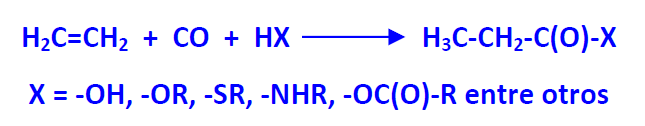
Los catalizadores utilizados son carbonilos metálicos de Ni, Co, Fe, Rh, Ru y Pd (ejemplo Ni(CO)4).
Un ejemplo de realización industrial de carbonilación es la transformación de etileno en ácido propanoico (ac. propiónico) por reacción con agua y CO (también llamado hidrocarboxilación). La reacción se realiza en fase líquida introduciendo etileno y CO a 200-240 atm y 270-320 (C Como catalizador se emplea Ni(CO)4.

El ácido propanoico así obtenido (Rto. = 95%) se usa principalmente como conservante en la industria alimenticia y para la preparación de piensos (sus sales Ca y Na). El propanoato de calcio se usa para evitar la aparición de mohos en productos de panadería. Otra aplicación es la obtención de ésteres (propanoato de isoamilo (isopentilo) es un disolvente para resinas y derivados de celulosa; el propanoato de vinilo se usa como monómero en la fabricación de pinturas) y en la producción de herbicidas.
Si en este proceso se emplean olefinas superiores se producen isomerizaciones de los dobles enlaces y se obtienen mezclas de ácidos carboxílicos por lo que este procedimiento sólo es útil para el etileno.
La utilización del proceso Reppe para propeno se realiza con un catalizador modificado de pentacarbonilo de hierro (Fe(CO)5.NR3 que permite la obtención de butanol e isobutanol en proporción 85:15, en lugar de los ácidos correspondientes. Este procedimiento se verá en el tema de alcoholes.

7.- Síntesis de ácidos carboxílicos (reacción de Koch).
La hidrocarboxilación de alquenos superiores se realiza industrialmente con CO y agua utilizando catalizadores ácidos. Los más adecuados son ácidos minerales como H2SO4, HF, H3PO4, bien solos o combinados con BF3 o SbF5.
En el transcurso de la reacción primero se adiciona el protón formándose el carbocatión más estable. Después se adiciona el CO al carbocatión y se forma un carbocatión acilio, que finalmente reacciona con agua para dar el ácido carboxílico correspondiente, o con alcoholes para dar directamente un éster. Aunque se obtienen mezclas isómeras de ácidos trabajando a elevadas temperaturas (80 ºC) se forman mayoritariamente los ácidos carboxílicos terciarios (partiendo de todos los isómeros del buteno, tras largos tiempos de reacción se obtiene mayoritariamente el ácido trimetilacético). Si bien para obtener este se parte generalmente de isobuteno [CH2=C(CH3)2].
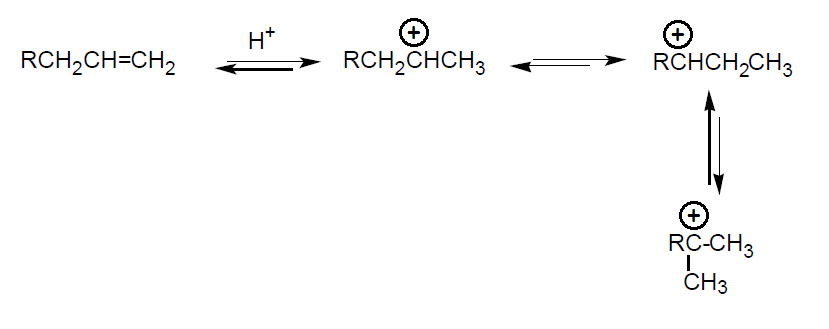
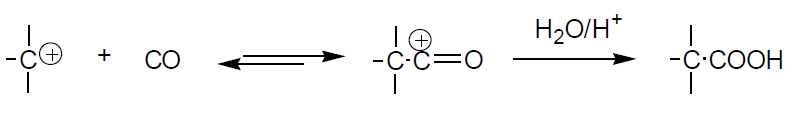
Los ácidos terciarios obtenidos son muy estables térmicamente y difíciles de esterificar (escasa reactividad del grupo ácido por impedimento estéreo). Los esteres son estables a la temperatura, a la oxidación y a la hidrólisis, y por ello se utilizan como aditivos en aceites lubricantes para disminuir su viscosidad en frio y como modificadores de resinas. Los ácidos sirven para elaborar resinas y lacas. El pivalato de metilo es un comonómero para plásticos. A escala industrial el CO se adiciona al alqueno en presencia del catalizador y en las condiciones experimentales adecuadas (20-80 ºC y 20-100 atm). En el segundo paso se introduce el agua. La selectividad del proceso es muy elevada (80-100%). Además del ácido trimetilacético, por este procedimiento se obtienen ácidos ramificados de 6 a 11 átomos de carbono.
[(CH3)3-COOH: ácido piválico]