Química Orgánica Industrial
Productos de interés industrial derivados del etileno
Autor: Ascensión Sanz Tejedor
1.- Productos químicos derivados del etileno.
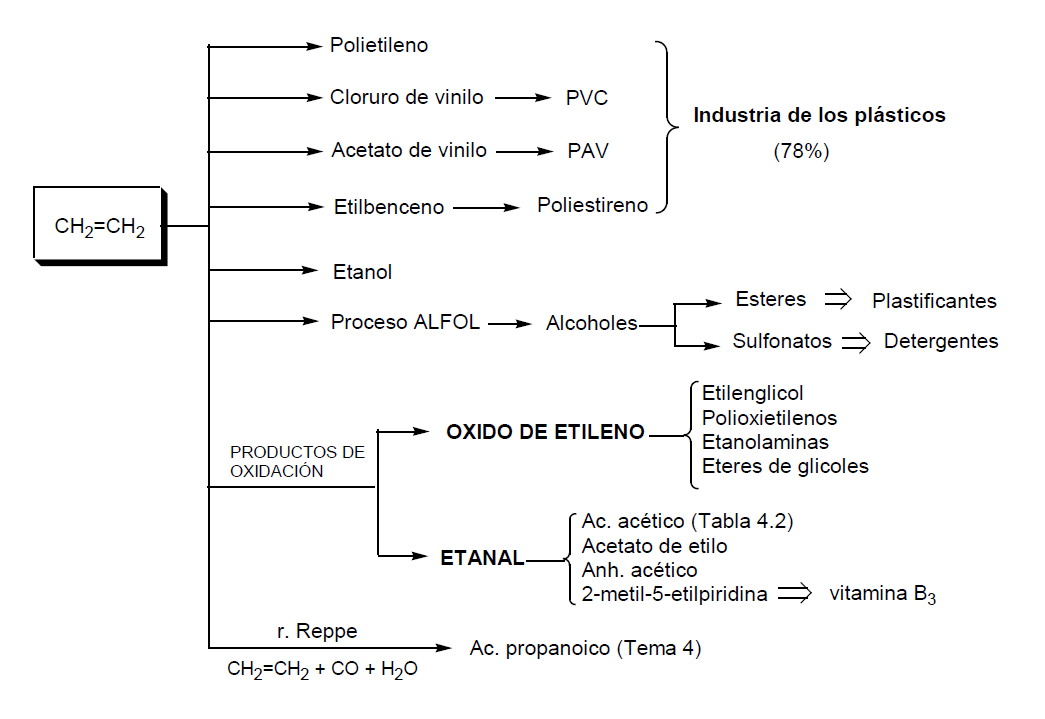
El etileno es la materia prima orgánica de mayor consumo en la industria química. La producción mundial es de aproximadamente 100x106 Tm anuales. Más del 30% de la industria petroquímica deriva del etileno. En el esquema y en la Tabla 5.1 se resumen los productos industriales que derivan de él. El mayor consumo (aproximadamente el 78%) es para la producción de plásticos, bien directamente para polietileno (PE), bien como materia prima para monómeros del PVC, poliacetato de vinilo (PAV) y poliestireno y también como copolímero para cauchos.
El puesto siguiente, en consumo de etileno, corresponde al óxido de etileno que es materia intermediaria para etilénglicol y para poliéteres disolventes y tensoactivos. Los puestos siguientes corresponden al etanol y al acetaldehído que son intermediarios para importantes síntesis industriales, sobre todo en las ramas del ácido acético. Los demás derivados se producen en cantidades menores: alcoholes C8 a C14 para detergentes y plastificantes y derivados clorados diversos.
| Producto | Mundo | USA | Eur. Occ. | Japón |
| Polietileno (LDPE Y HDPE) | 57 | 49 | 58 | 43 |
| Cloruro de vinilo | 14 | 15 | 14 | 18 |
| Óxido de etileno y productos secundarios | 13 | 13 | 10 | 11 |
| Acetaldehído y productos secundarios | 1 | 1 | 2 | 4 |
| Etilbenceno y estireno | 7 | 7 | 7 | 12 |
| Otros (etanol, acet. de vinilo, 1,2-dibromoetano, cloruro de etilo, propionaldehído, etilenimina...) | 8 | 15 | 9 | 12 |
| Uso total (en 106 Tm) | 100 | 31,3 | 30,0 | 17,4 |
Los productos de oxidación parcial del etileno más importantes son el óxido de etileno (OE) y el acetaldehído.
2.- Oxido de etileno (OE).
El producto químico más importante derivado del etileno, que no es precursor de polímeros, es el óxido de etileno. El OE es un gas tóxico a temperatura ambiente, de Tb = 10,7 °C y Tf = -112 °C que forma mezclas explosivas con el aire. Es soluble en agua en todas proporciones. Es un compuesto tóxico, inflamable y se maneja líquido en recipientes a presión.
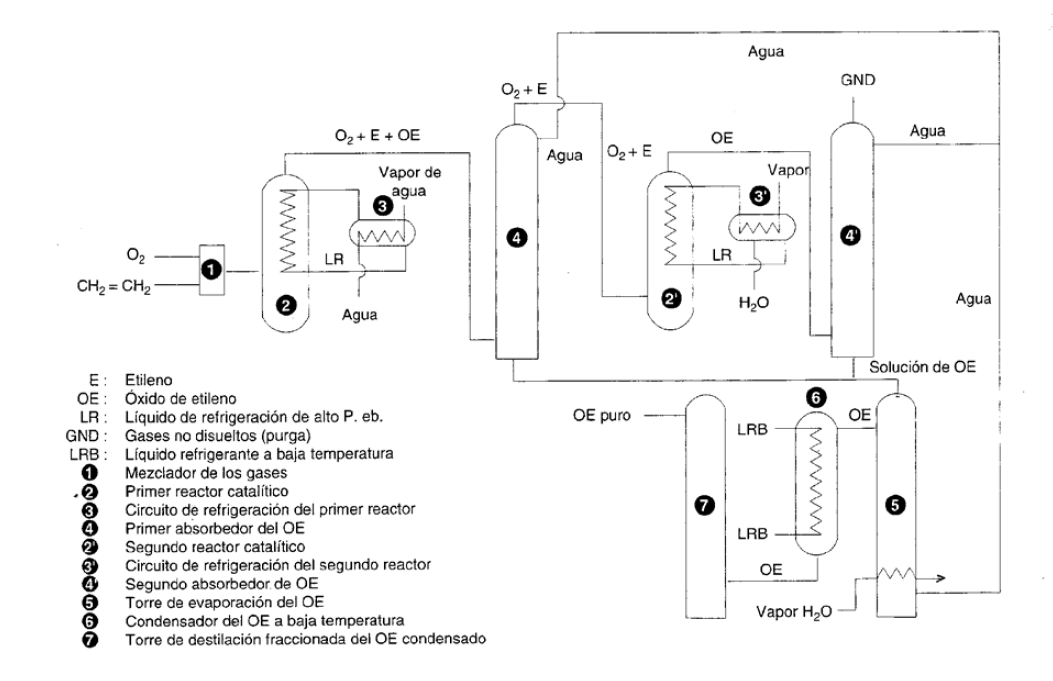
La producción mundial de este compuesto es de unos 14,5 millones de Tm/año. El óxido de etileno se produce en instalaciones con capacidad superior a las 100.000 Tm/año. Actualmente el proceso de fabricación consiste en la oxidación directa del etileno con una corriente de oxígeno utilizando catalizadores de plata. El oxígeno se obtiene mediante una planta de fraccionamiento de aire. El catalizador contiene hasta un 15% en peso de plata, depositada en forma de capa fina sobre un soporte inerte y poroso de alúmina (Al2O3).
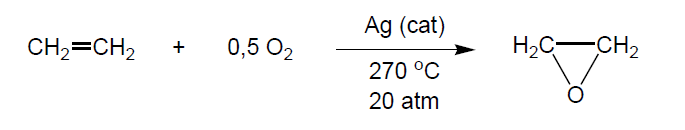
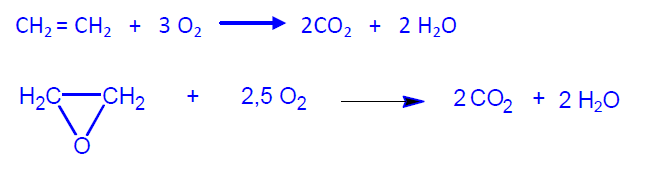
La reacción de transformación del etileno en OE es exotérmica con una entalpía de (H = -105 kJ/mol. No obstante, la reacción principal va acompañada de otras dos reacciones secundarias, aún más exotérmicas, que son la combustión total del etileno ((H = -1327 kJ/mol) y la reoxidación del óxido de etileno ((H = -1223 kJ/mol) a dioxido de carbono y agua. Debido a la contribución de estas reacciones secundarias, los procesos industriales alcanzan una selectividad próxima al 80%, en los que se produce un desprendimiento medio de calor de aproximadamente 500 kJ/mol de etileno consumido.
El principal problema de este proceso es la evacuación eficaz del calor de reacción, ya que un recalentamiento del catalizador disminuye su actividad y su vida media. Para ello el reactor empleado contiene el catalizador rígidamente ordenado en haces tubulares, con varios miles de tubos, por los que circula la mezcla de reacción. Como medio calefactor circula entre los tubos un líquido refrigerante, como, por ejemplo, queroseno o tetralina (tetrahidronaftaleno). El calor generado en el proceso se utiliza para producir vapor de agua y obtener energía.
Otro factor a considerar, es la necesidad de limitar la conversión de etileno al 10%, para eliminar de manera adecuada el calor de reacción, ya que las mezclas oxígeno-OE y etileno-oxígeno son muy explosivas.
El OE obtenido se separa del resto de los gases del proceso haciéndolo pasar por un absorbedor que contiene agua. Sólo el OE queda retenido. El CO2 formado como subproducto se elimina por sucesivos lavados con disolución acuosa de potasa, y los demás gases, etileno sin reaccionar y oxígeno, se reciclan. El óxido de etileno se seca parcialmente y se usa directamente para transformarlo en los productos correspondientes.
El óxido de etileno, como tal, sólo se utiliza como fumigante para graneros e invernaderos, como esterilizante y como inhibidor de la fermentación. La importancia del OE radica en la elevada reactividad del anillo de oxirano. Las transformaciones del óxido de etileno se realizan por apertura del ciclo de tres eslabones con reactivos nucleófilos tales como agua, alcoholes, fenoles, amoniaco, aminas, ácidos carboxílicos o mercaptanos.
2.1.- Productos derivados del óxido de etileno.
En la Tabla 5.2 se indican los productos que derivan del OE.
| Producto | Mundo | USA | Eur. Occ. | Japón |
| Etilenglicol | 61 | 57 | 44 | 59 |
| Tensoactivos no iónicos1 | 16 | 11 | 28 | 17 |
| Etanolaminas | 6 | 11 | 9 | 4 |
| Éteres glicólicos | 4 | 7 | 7 | 5 |
| Otras aplicaciones2 | 13 | 14 | 12 | 15 |
| Uso total (106 Tm) | 14,5 | 3,8 | 2,2 | 0,97 |
| 1. Polioxietilenos; 2. Poliuretanos, etilenglicoles superiores | ||||
Etilenglicol.
De los diversos productos secundarios derivados del óxido de etileno el más importante es el etilenglicol. Es un líquido de Tb = 198 °C y Tf = -12 °C, soluble en agua en todas proporciones. Es muy tóxico porque en el organismo se metaboliza a ácido oxálico (HOOC-COOH). La producción mundial de etilenglicol es de 13,6x106 Tm. Se obtiene por adición de agua al óxido de etileno.
En el proceso industrial de fabricación se hace reaccionar el OE con agua en exceso para evitar la formación de polímeros (10 veces en exceso molar).
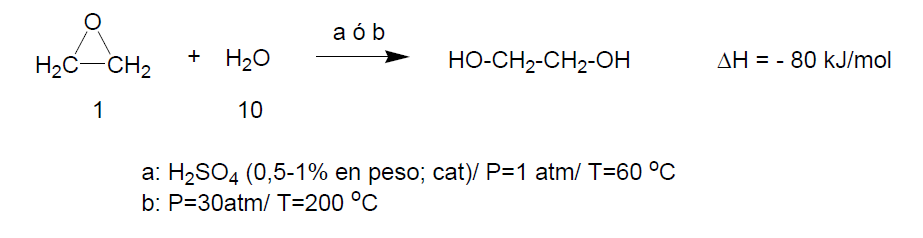
La reacción puede llevarse a cabo en presencia de ácido sulfúrico como catalizador a presión atmosférica y a 50-70 ºC, o bien sin catalizador a 200 ºC y de 20 a 40 atm. La selectividad es sólo del 90% y el rendimiento del 96%. La fabricación de etilénglicol se realiza casi exclusivamente en un reactor acoplado al de obtención de óxido de etileno por oxidación de etileno. La disolución resultante se concentra por evaporación hasta el 70 %. El EG se purifica por destilación fraccionada.
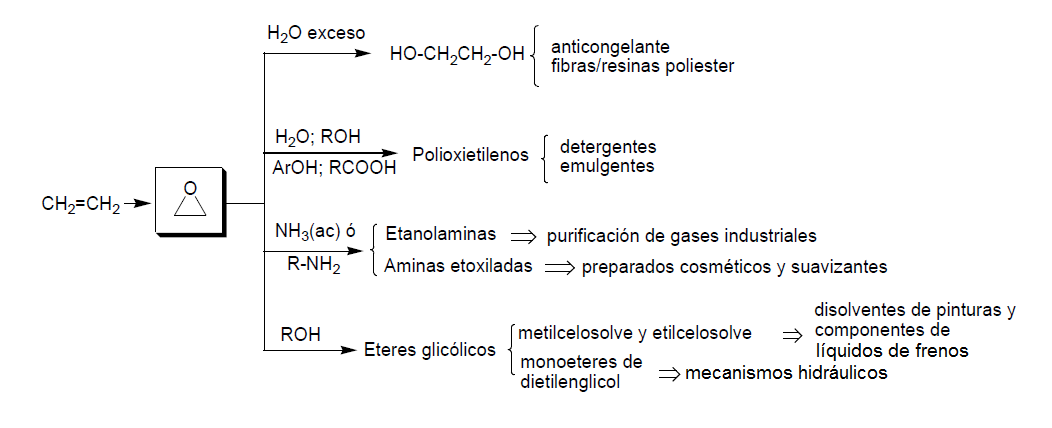
El etilenglicol tiene dos campos de aplicación principales: como anticongelante del circuito de refrigeración de los motores (la mezcla glicol-agua en proporción 1:1 congela a -35 ºC) y como diol para la obtención de diversos polímeros. Los más importantes son los poliesteres obtenidos por reacción de etilénglicol con un diácido. La fibra de poliéster más utilizada es el tereftalato de etilenglicol (fibra de poliéster).
En la Tabla 5.3 se muestran los principales usos del etilénglicol en diferentes países.
| Producto | USA | Eur. Occ. | Japón | Mundo |
| Anticongelante | 25 | 29 | 20 | 16 |
| Fibras de poliéster | 32 | 35 | 61 | 57 |
| Películas/resinas de poliéster1 | 28 | 8 | 5 | |
| Otros usos2 | 15 | 28 | 19 | 22 |
| Uso total (106 Tm) | 1,2 | 1,03 | 0,30 | 13,6 |
| 1. Cintas magnéticas de audio y vídeo, cintas transportadoras y paneles decorativos. 2. Policarbonatos (por reacción con fosgeno) y poliuretanos (por reacción con diisocianatos |
||||
Tensoactivos no iónicos: Polioxietilenos.
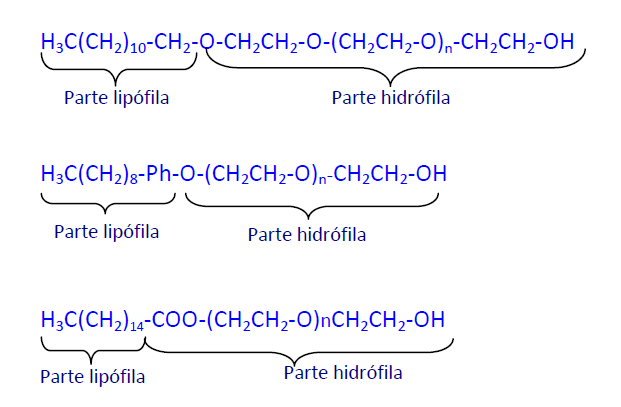
La segunda aplicación más importante del OE es la preparación de compuestos de polioxietileno con una producción de 3,5x106 Tm/año. Se obtienen por reacción del OE con alcoholes de cadena larga, alquilfenoles, ácidos grasos o agua.
La polimerización del OE con una cantidad de agua inferior a la estequiométrica (OE:agua = 10-30 moles: 1) da los polioxietilénglicoles que, según el valor de n, son líquidos muy viscosos, semisólidos o sólidos céreos (carbobax) con pesos moleculares que oscilan entre 50.000 y 2.000.000. Estos productos son solubles en agua y se usan para fabricar cremas y emulsiones grasas útiles como plastificantes y para la obtención de poliuretanos.
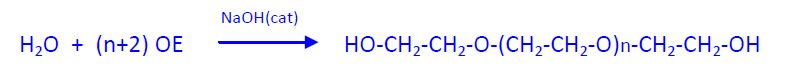
Si el OE se hace reaccionar con alcoholes de cadena larga, con alquilfenoles (octil, nonil, dodecil) o con ácidos grasos se obtienen tensoactivos no iónicos utilizados como detergentes, humectantes, dispersantes y como emulgentes para formulaciones insecticidas. El balance lipofilia/hidrofilia (L/H) depende de la longitud de la cadena alquílica y del número de grupos etoxilo. La solubilidad en agua se alcanza cuando n es igual o un poco mayor que el número de carbonos de la cadena alquílica.
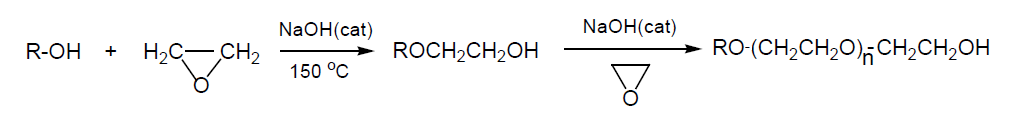
Etanolaminas.
Las etanolaminas son productos industriales valiosos que se obtienen por reacción del OE con amoniaco y aminas. Su producción está en torno a 1x106 Tm/año.
La reacción con disolución de amoniaco acuoso al 30% (NH3:OE 10:1) da lugar a una mezcla de monoetanolamina y dietanolamina, en proporción 75:25. Se añade exceso de amoniaco para minimizar la formación de dietilamina. Estos compuestos se utilizan, por su carácter débilmente básico, para purificar gases gases industriales (CO2, SO2, SO3, SH2, etc).
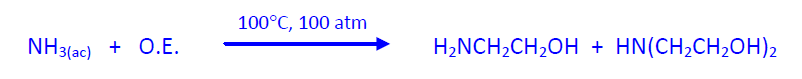
La monoetanolamina es un líquido viscoso de Tb = 170,8 ºC, Tf = 10,3 ºC y d = 1,012. La dietanolamina también es un líquido viscoso cuya Tb = 268,8 ºC, Tf = 28 ºC y d = 1,088.
Por reacción con aminas de cadena larga se obtienen aminas etoxiladas que son tensoactivos no iónicos empleados en preparados cosméticos y como suavizantes.

Éteres de glicoles utilizados como disolventes.
La reacción del OE con alcoholes da lugar a éteres glicólicos. El O.E. se introduce en el reactor que contiene el alcohol en exceso y sosa (NaOH) al 2%. Se opera a a 150 °C y 10 atm. Los alcoholes más empleados son metanol, etanol y butanol.

Los éteres metílico y etílico se llaman metilcelosolve (MeOCH2CH2OH) y etilcelosolve (EtOCH2CH2OH). Se emplean como disolventes de pinturas, disolventes de nitrocelulosa, como componentes de los líquidos de frenos para ajustar su viscosidad, como emulgentes para aceites minerales y vegetales, así como para la preparación de pasta para bolígrafos y tintas de imprenta.
Los monoéteres de dietilénglicol (MeOCH2CH2OCH2CH2OMe) y de trietilénglicol se usan para líquidos de frenos y otros mecanismos hidráulicos (prensas, elevadores, etc).
En el siguiente esquema quedan resumidos los principales productos industriales que derivan del óxido de etileno, así como sus principales aplicaciones. El hidroxieter que deriva del butanol es uno de los componentes de los líquidos limpiacristales.
3.- Acetaldehído o etanal. Producción industrial.
El etanal es un líquido miscible en agua y en disolventes orgánicos en todas proporciones. Su Tb = 20,8 ºC, Tf = -1123,5 ºC y d = 0,805 g/cc.
Aproximadamente un 2% de la producción de etileno se usa para la obtención de etanal. La producción mundial de etanal es de 3x106 Tm, siendo el mayor consumo para la producción de ácido acético y acetato de etilo. Actualmente, casi todo el etanal que se produce industrialmente se obtiene por oxidación catalítica del etileno, según el proceso Wacker-Hoechst (ΔH = -243 kJ/mol) utilizando un reactor de Titanio.
El catalizador es un sistema de dos componentes, que consta de PdCl2 y CuCl2. El catalizador actúa a través de la formación de un complejo (entre el etileno y el PdCl2 que evoluciona, de manera rápida, dando etanal y Pd metálico. Seguidamente tiene lugar la regeneración del catalizador, en un proceso en dos pasos que determina la velocidad del proceso. En el primero el CuCl2 oxida el Pd a Pd++ y el se reduce a CuCl, pero las sales de Cu(I) son inestables y en presencia de aire se oxidan de nuevo a Cu++.
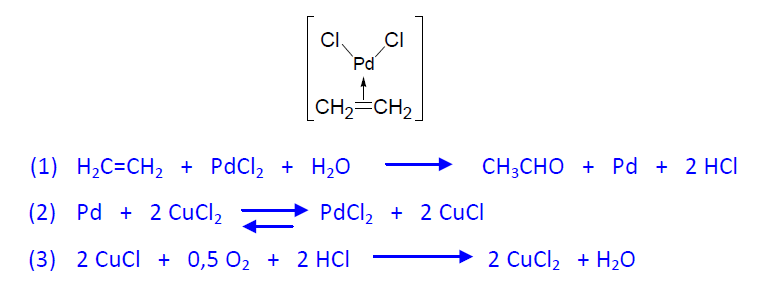
La reacción globlal queda:

El proceso industrial puede realizarse en una o en dos etapas. En el primer caso, en el mismo reactor se produce simultáneamente la reacción y la regeneración del catalizador. Como oxidante se emplea O2. La mezcla de gases, etileno y O2, se introduce, a 3 atm, en el reactor que contiene una disolución ácida (ácido clorhídrico) de PdCl2 y CuCl2 a 130 ºC. El etileno y el oxígeno han de ser muy puros (99,9% en volumen) para evitar pérdidas de etileno con los gases inertes. Simultáneamente se produce la reacción y la regeneración. La conversión de etileno se limita a un 35-45%, para evitar explosiones, por lo que es necesario reciclar el etileno y el O2. El calor desarrollado en la reacción se emplea para destilar el etanal, así como el agua de la disolución del catalizador. Por destilación fraccionada se recuperan el acetaldehído y el agua y, a continuación, se recupera el catalizador.
En el proceso en dos etapas la reacción y la regeneración se realizan en dos reactores separados. En el primer reactor se hace reaccionar el etileno con la disolución catalítica, a 110 °C y 10 atm, hasta casi transformación total.
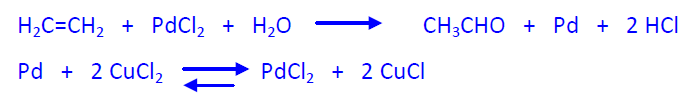
El etanal, así obtenido, se purifica por destilación fraccionada para eliminar el agua. La disolución catalítica se trasvasa al segundo reactor (reactor de oxidación) para su regeneración. Esta se efectúa con una corriente de aire a 100 ºC y 10 atm.
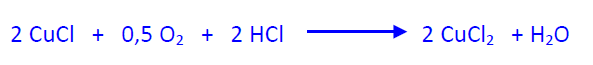
La principal ventaja de este procedimiento es que se consigue la transformación casi total de etileno en etanal. El principal inconveniente se encuentra en unos gastos de inversión elevados por necesitar dos reactores. En ambos procesos el etanal bruto acuoso se purifica por destilación. La selectividad en ambos casos es del 94%.
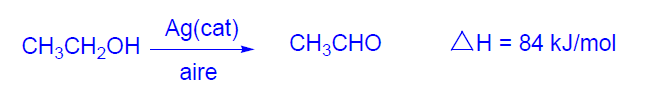
El etanal también se obtiene por deshidrogenación de etanol en países productores de etanol por fermentación. El proceso es endotérmico y requiere aporte de energía.
El etanal es un producto intermedio importante para la obtención de numerosos productos orgánicos básicos tales como: ácido acético, anhídrido acético, cetena-dicetena (H2C=C=O), acetato de etilo, 2-butenal (crotonaldehído), n-butanol, pentaeritritol, tricloroacetaldehído y muchos más. La cantidad de acetaldehído utilizada para cada producto difiere de unos países a otros. En Europa la mayor parte de la producción de etanal se consume en ácido acético y acetato de etilo (Tabla 5.4), si bien estos compuestos pueden obtenerse por otros procedimientos.
| Producto | Eur. Occ. | USA | Japón |
| Ác. acético/Anh. acético | 46 | - | 29 |
| Butanol | 16 | - | - |
| Otros (piridina, pentaeritrol, ác. peracético) | 38 | 100 | 71 |
| Uso total (106 Tm) | 0,55 | 0,15 | 0,35 |
Ácido Acético.
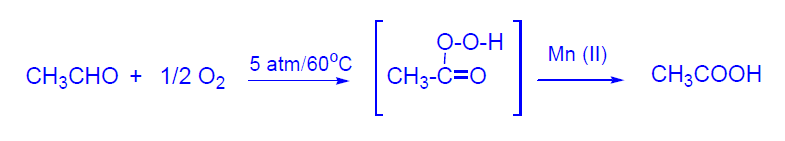
La producción mundial de ácido acético es de 8,3x106 Tm. El ácido acético puede obtenerse por oxidación del etanal según un proceso radicalario con ácido peracético como intermedio. El proceso se lleva a cabo en fase líquida y requiere un estricto control de la temperatura para evitar la descomposición del ácido acético. Como catalizado se emplea una disolución de acetato de Mn o Co. (ver producción de ac. acético desde metanol en tema 4).
El uso principal del ácido acético es para la obtención de diferentes esteres acéticos que se utilizan como monómeros de plásticos vinílicos. El de mayor producción es el acetato de vinilo para la preparación de poliacetato de vinilo, seguido del acetato de celulosa. Los acetatos de sodio, plomo, aluminio y cinc se utilizan como auxiliares en la industria textil, colorantes y medicina.
Anhídrido Acético.
La producción mundial de anhídrido acético es de 2x106 Tm.Se obtiene por oxidación de etanal en presencia de acetatos de una mezcla de triacetato de cobalto y diacetato de cobre como catalizador.
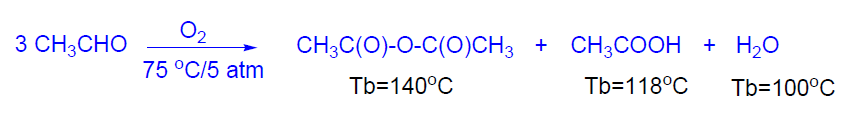
Hay que eliminar el agua por destilación para evitar que hidrolice el anhídrido acético al correspondiente ácido. El anhídrido acético es un producto importante en la IQO. Se usa como agente acilante sobre todo para acetato de celulosa, aspirina, colorantes, etc. Es menos corrosivo que el ácido acético.
Butanol.
Se obtiene por condensación aldólica de etanal, en medio básico, seguido de reducción con H2/Ni del producto de condensación.
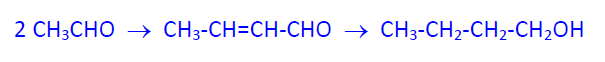
Acetato de Etilo.
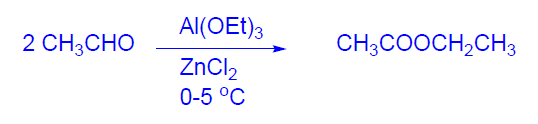
En cuanto al acetato de etilo (Tb = 77 ºC) la producción mundial es de 1,2x106 Tm. P>ede obtenerse por desproporción de etanal en reactores refrigerados porque el proceso es muy exotérmico. La conversión es del 95% y la selectividad del 96%. El catalizador es una disolución de etilato de aluminio en etanol-acetato de etilo con ZnCl2. Su principal aplicación es como disolvente en la industria de las pinturas y barnices, y como disolvente de extracción en la preparación de productos farmacéuticos.
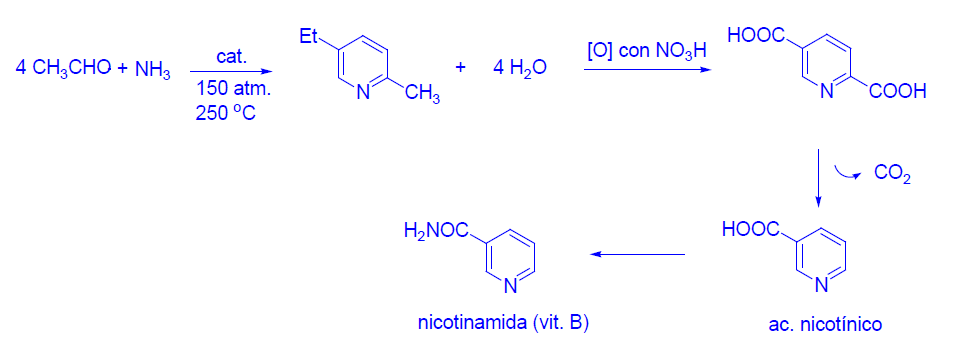
2-metil-5-etilpiridina.
A partir de este compuesto se obtiene la nicotinamida o factor PP preventivo de la pelagra.