Química Orgánica Industrial
Alcoholes de interés industrial
Autor: Ascensión Sanz Tejedor
1.- Alcoholes inferiores.
Los alcoholes inferiores de mayor importancia industrial son metanol, etanol, isopropanol y los butanoles. El alcohol alílico (CH2=CHCH2OH) se encuentra también en este grupo por su importancia cada vez mayor. Los alcoholes amílicos (mezclas de pentanoles) tienen menos aplicación pero sus aplicaciones se están incrementando.
Como ya mencionamos anteriormente el metanol es el más importante en todos los países industriales por las cantidades que de él se consumen (producción 40x106 Tm). El etanol le sigue en segundo puesto con una producción bastante menor. En países como USA o Inglaterra el precio lo fija la ley de la oferta y la demanda, pero en Japón y en los países de la Europa Occidental, con objeto de proteger el alcohol obtenido por fermentación de residuos agrícolas, el alcohol de síntesis tiene su precio fijado. El tercer lugar lo ocupa el isopropanol (2-propanol).
La fuente fundamental de estos alcoholes son los alquenos procedentes del craqueo de las naftas.
1.1.- Etanol.
El etanol es un líquido de Tb = 78,3 ºC, Tf = -114 ºC y soluble en agua en todas proporciones. La producción mundial de etanol, obtenida desde etileno, es de 2,6x106Tm, de las cuales 0,59x106; 0,58x106 y 0,11x106Tm por año estuvieron localizadas en USA, Europa Occidental y Japón respectivamente. En estos mismos países la producción de etanol por fermentación fue de 5,6x106; 0,56x106 y 0,16x106Tm al año, respectivamente.
Actualmente por fermentación de productos agrícolas se obtienen alrededor de 24x106 Tm de etanol por año. Las materias primas son: mosto de uva, melazas residuales de la fabricación de sacarosa, almidón hidrolizado de patata, de maíz, o de otros cereales, líquidos residuales de industrias de alimentos o caldos procedentes de la hidrólisis de materiales celulósicos (paja, tallos, residuos forestales...). La mayoría de las plantas se encuentran en Brasil, India y USA si bien Japón, Méjico, Sudáfrica y varios países de Europa Occidental son también productores. El primer país productor de etanol por fermentación es Brasil (a partir de caña de azúcar).
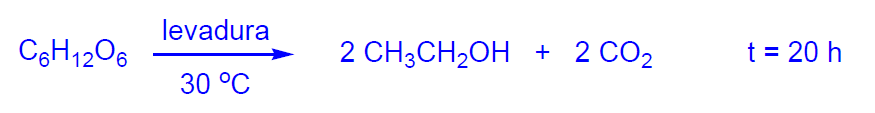
La concentración del etanol así obtenido es del 15%, por lo que la destilación posterior para obtener etanol es muy costosa.
El etanol de síntesis se ha obtenido industrialmente a partir de etileno según dos procesos:
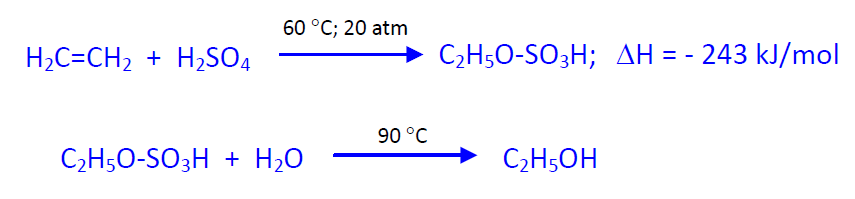
- Por hidratación indirecta adicionando ácido sulfúrico y posterior hidrolisis del éster sulfúrico obtenido y
- Por hidratación directa catalítica. Si bien el primero de estos ha dejado de utilizarse por ser muy contaminante.
En el proceso indirecto los gases que contienen etileno (su porcentaje puede variar entre el 35 y el 95%) se hacen reaccionar en un sistema de torres de absorción con ácido sulfúrico del 98% a unos 60 ºC y 20 atm. Utilizando Ag2SO4 como catalizador. Los esteres sulfúricos obtenidos se diluyen con agua y se calientan con vapor de agua, a unos 90 ºC, para hidrolizar el éster sulfúrico a etanol. La selectividad del proceso es del 86%. El etanol se purifica por destilación y el ácido se concentra para reutilizarlo. En este último paso se forman pequeñas cantidades de SO2. El principal inconveniente de este procedimiento son los problemas de corrosión debidos al ácido sulfúrico y que es un proceso muy contaminante. En USA no utilizan este procedimiento desde 1974 y en Europa desde 1980.
Si se utiliza una mezcla de alquenos (etileno, propeno y 2-metilpropeno) procedente del craqueo de las naftas, se va aumentando gradualmente la concentración de ácido sulfúrico con lo que el 2-metilpropeno reacciona primer, seguido del propeno y finalmente el etileno.
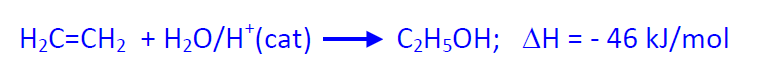
En el proceso directo la hidratación se realiza en fase gaseosa sobre catalizadores ácidos generalmente H3PO4 fijado sobre un soporte sólido de SiO2 o sobre una resina. Las condiciones de trabajo son 300 ºC y 70 atm (para favorecer el equilibrio a la derecha) y tiempos cortos de reacción para evitar la formación de productos secundarios (éter dietílico y oligómeros). La conversión del etileno sólo es de 5% y la selectividad del 97%; el alcohol se condensa y los gases se reciclan múltiples veces para alcanzar su rendimiento económico (97%), para lo cual es necesario o una alta pureza de etileno o una eliminación de gases para evitar un aumento de gases inertes en el reciclado.
El etileno obtenido por destilación tiene un 4% de agua (Tbaz = 78,15 (C). Para obtener etanol absoluto se añade benceno y destilan los siguientes azeótropos:
- Etanol-benceno-agua (7,5% de agua) con una Tb = 64,8 ºC; (22,8% EtOH; 53,9 % benceno; 23,3% H2O) hasta que se elimina todo el agua.
- Etanol-benceno (80% de benceno) con una Tb = 68,2 ºC hasta total eliminación de benceno, y
- Etanol absoluto a 78,3 ºC.
Otro método consiste en hacer circular etilénglicol a contracorriente en la columna de destilación, el cual fija el agua. Los restos de agua que quedan se eliminan añadiendo Mg y destilando en ausencia de aire o pasándolo a través de tamices moleculares (zeolitas sintéticas) que retiran el agua y se regeneran calentándolas. Un método para detectar trazas de agua en el etanol consiste en añadir CaC2 y CuSO4 que forman, respectivamente, acetileno y acetiluro de cobre rojo muy visible.
Actualmente se están desarrollando nuevas tecnologías para obtener etanol por carbonilación de metanol. Igualmente se están optimizando los procesos de fermentación.
El etanol se usa como desinfectante, disolvente y aditivo para gasolina para aumentar el índice de octanos. Hay una demanda creciente de etanol para carburante, en mezclas para gasolina hasta el 15%, que se está incrementando en algunos países importadores de petróleo. Además el etanol es un producto de partida para obtener etanal, ácido acético, esteres etílicos y cloroetano, todos ellos intermedios para distintas fabricaciones; siendo los dos más importantes el acetato de etilo y el cloroetano (anestesia local y agente etilante).
1.2.- Isopropanol (2-propanol).
Es un líquido de Tb = 82,5 ºC, Tf = -85,5 ºC, d = 0,785 y soluble en agua en todas proporciones.La producción mundial de isopropanol es de 2,1x106 Tm, de las cuales 0,65; 0,76 y 0,18x106 Tm por año estuvieron localizadas en USA, Europa Occidental y Japón, respectivamente.
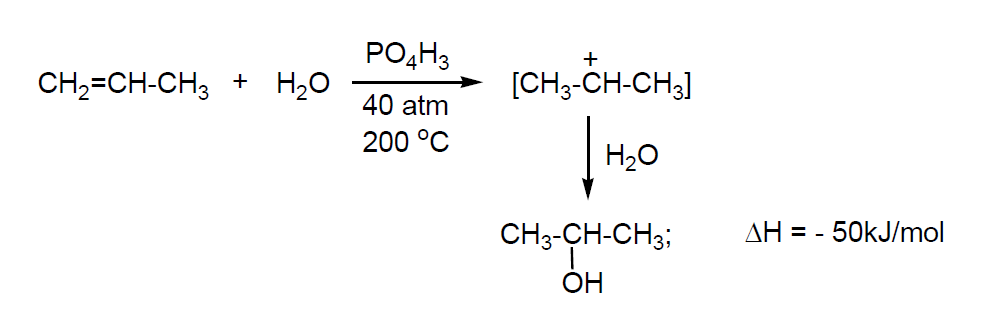
Los procesos industriales de fabricación son análogos a los del etanol por hidratación indirecta de propeno (por reacción con ácido sulfúrico del 94% en fase líquida; Shell) o hidratación directa del mismo. El primero es muy contaminante y se usa muy poco. En cuanto a la hidratación directa, actualmente hay dos procesos operativos:
A) Hidratación en fase gas.
La hidratación en fase gaseosa utiliza catalizadores ácidos generalmente H3PO4 fijado sobre un soporte sólido de SiO2 o sobre una resina. Las condiciones requieren presiones elevadas para favorecer que el equilibrio se desplace hacia la derecha. La hidratación directa transcurre con una selectividad del 97% y una conversión del 6%, por lo que es necesario reciclar el propeno que no ha reaccionado. Como catalizadores se utilizan WO3/SiO2 (requiere P = 250 atm) o H3PO4/SiO2 (P = 40 atm). El isopropanol se purifica por destilación y el agua del azeótropo se elimina por destilación con benceno (Veba en Alemania).
B) Hidratación en fase líquida.
La Deutsche Texaco en 1986 desarrolló un nuevo procedimiento que consiste en la introducción de agua líquida y propeno gas en un reactor que contiene una resina de intercambio iónico. Se opera a ( 150 (C y 100 atm. Se consiguen conversiones del 75% y una selectividad en torno al 94%.
Una resina de intercambio iónico es un polímero sólido que tiene unidos por enlace covalente grupos ácidos o básicos. Por ejemplo un polímero de estireno y divinilbenceno. Estas resinas tienen un grado de polimerización adecuado para que sus granos se hinchen con agua y sus grupos ácidos o básicos se ionicen formando una matriz cargada con iones susceptibles de intercambiarse.
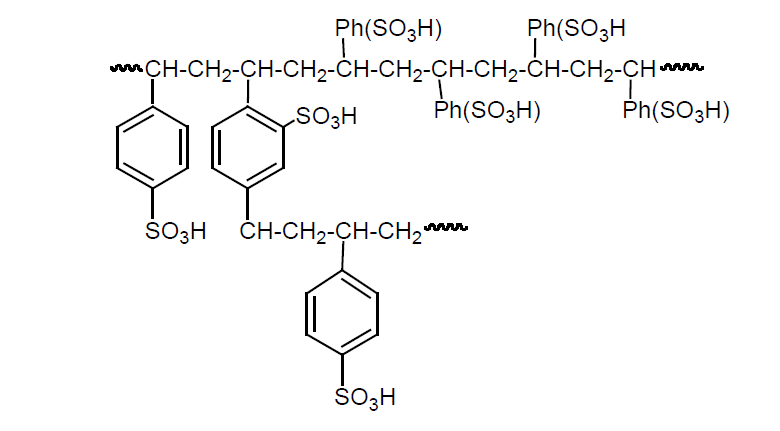
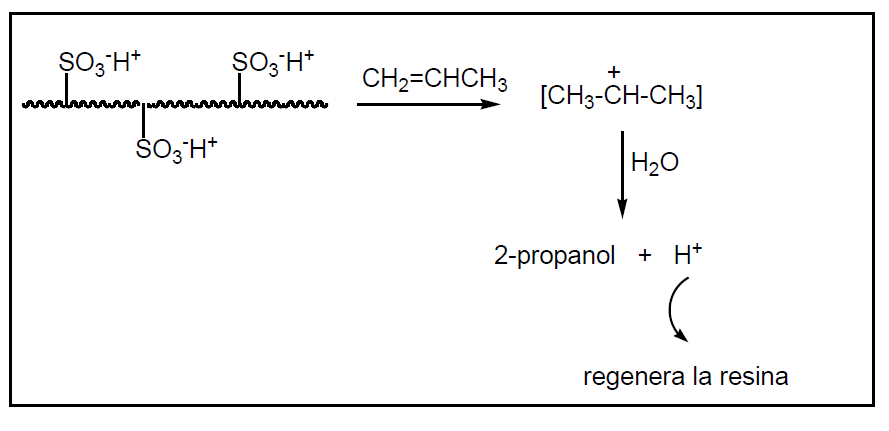
Aproximadamente el 20% del isopropanol obtenido se destina a la fabricación de acetona. También se usa como aditivo anticongelante para gasolina y es un buen disolvente industrial por su volatilidad intermedia (Tb = 82,5 ºC), por su poder disolvente amplio y por su olor suave y agradable. Así, se usa para extraer grasas, colorantes y compuestos malolientes en las fábricas de harina de pescado y sustituye al etanol en los productos de cosmética, que exigen una evaporación más lenta y en farmacia (lociones para el afeitado).

Dos derivados importantes del isopropanol son el acetato de isopropilo y la isopropilamina. (El primero se utiliza, además que como disolvente y plastificante, mezclado con acetato de etilo y vidrio soluble para consolidar tierra. El ácido acético que resulta de la hidrólisis separa el ácido silícico del silicato alcalino que reticula el suelo consolidándolo. La isopropilamina es un producto intermedo en la síntesis de colorantes, productos químicos para el caucho, insecticidas y productos farmacéuticos.)
1.3.- Butanoles.
Los butanoles son líquidos a temperatura ambiente y su producción está en torno a los 2,5x106 Tm/año. En algunos países industrializados el volumen de producción de butanoles ocupa el segundo lugar después del metanol. Hay cuatro tipos de isómeros estructurales; 1-butanol, 2-metilpropanol (isobutanol), 2-butanol (secbutanol) y 2-metil-2-propanol (tercbutanol).
El método industrial de preparación depende del butanol que se quiera sintetizar.
A) Butanol/Isobutanol.
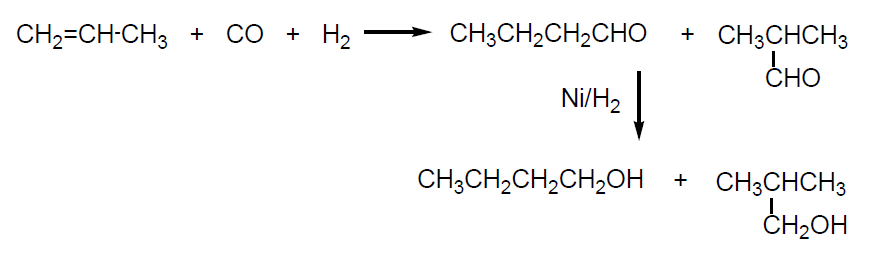
Hidroformilación de propeno y posterior hidrogenación de los aldehídos obtenidos, butanal e isobutanal, a los correspondientes alcoholes. Por este procedimiento se obtienen butanol e isobutanol en proporción 80:20 (tema 4).
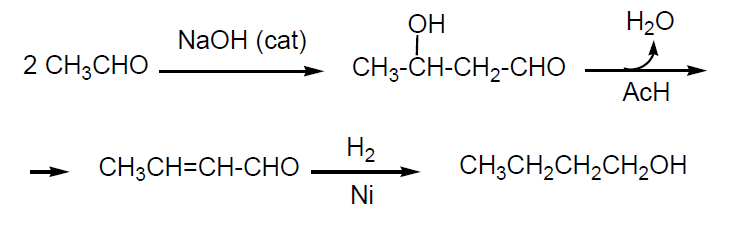
Condensación aldólica de acetaldehído seguido de hidrogenación del crotonaldehído resultante. El acetaldehído (obtenido por deshidrogenación de etanol) por condensación aldólica en medio básico da lugar a 3-hidroxibutanal que, se deshidrata fácilmente a 2-butenal (aldehído crotónico) en presencia de pequeñas cantidades de ácido acético. Este compuesto por hidrogenación catalítica se transforma en butanol. Esta vía de producción de butanol sólo se usa en Brasil que produce grandes cantidades de etanol por fermentación de caña de azúcar.
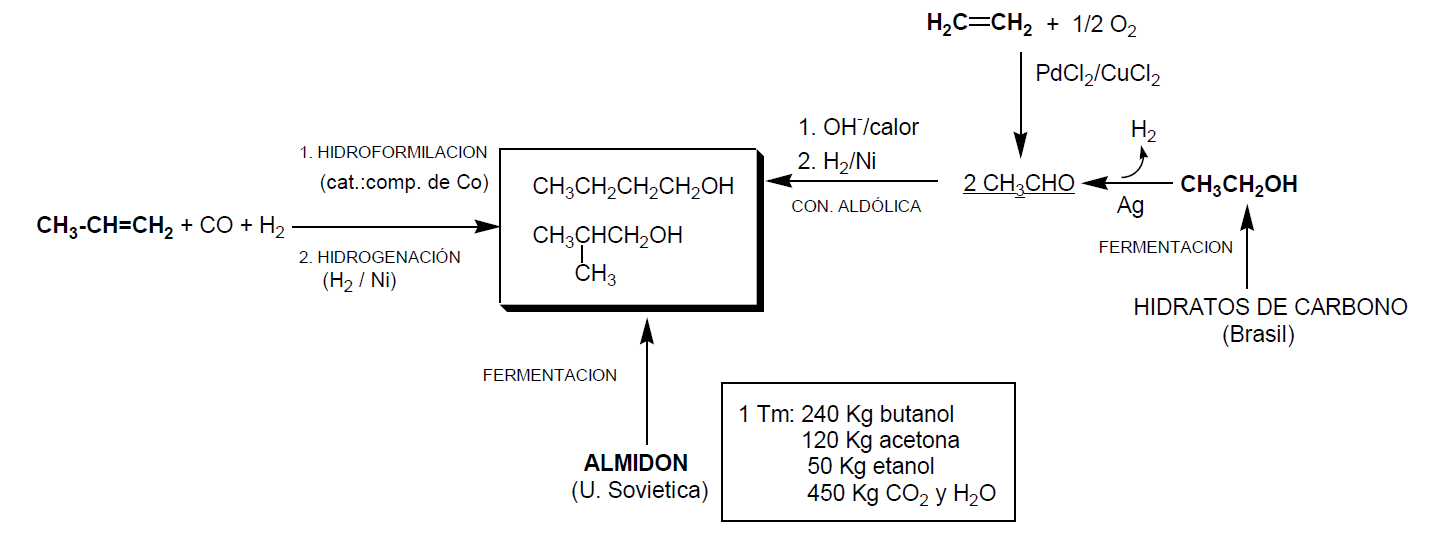
Fermentación de almidón (sólo en la antigua U. Soviética).
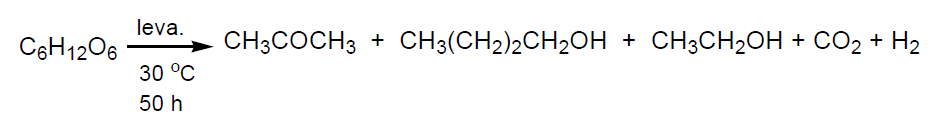
Por cada Kg de almidón fermentado se obtienen 240Kg de butanol, 120 Kg de acetona, 50 Kg de etanol y 450 Kg de CO2 y agua.
Los diferentes procedimientos industriales para obtener butanol e isopropanol quedan resumidos en el siguiente esquema:
Fabricación de butanol por fermentación de almidón.
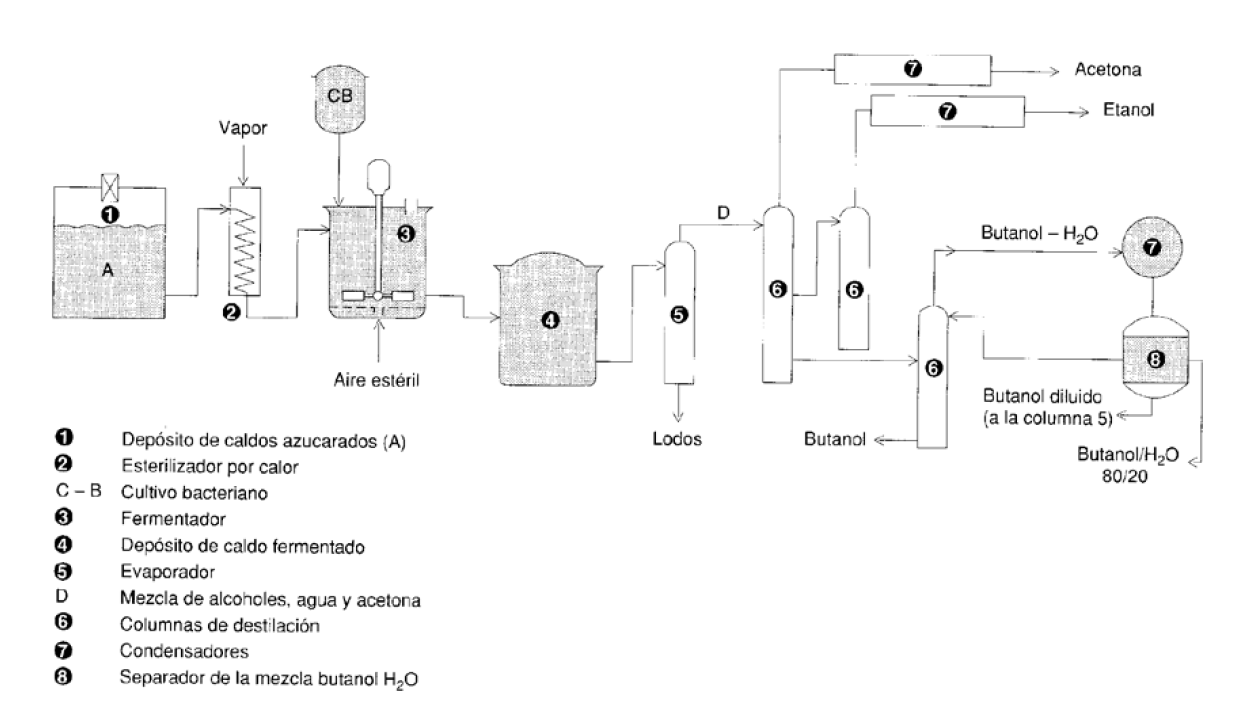
Reacción de propeno con CO y agua (proceso Reppe).
El proceso Reppe para la obtención de butanol e isobutanol consiste en la reacción de propeno con CO y agua en presencia de un catalizador modificado de pentacarbonilo de hierro (Fe(CO)5.NR3; Con Ni(CO)4 se obtiene ac. butanóico, ver tema 4) (ΔH = -239 kJ/mol). Se opera a 100 ºC y 15 atm. La selectividad es del 90%. Por este procedimiento se obtiene una mezcla de butanol:isobutanol en proporción 85:15.

El butanol a través de sus esteres (acetato de butilo y butanoato de butilo) se usa como disolvente de grasas, aceites, ceras, resinas y plásticos así como plastificante de PVC mediante su transformación en ftalato de di-n butilo.
B) 2-Butanol/2-Metil-2-propanol.
El 2-butanol y el 2-metil-2-propanol se obtienen, de manera análoga al etanol e isopropanol, por hidratación en fase líquida de los correspondientes alquenos, en presencia de resinas de intercambio iónico.
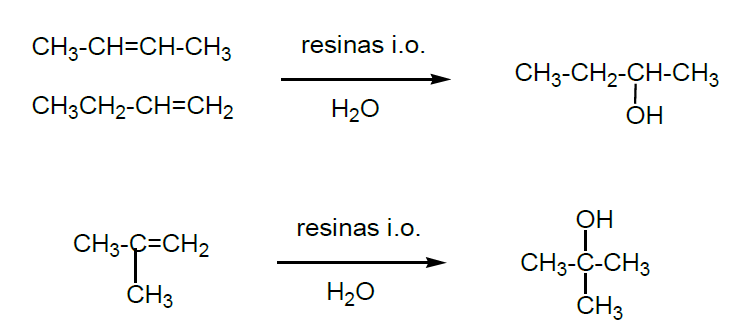
Todos los butanoles se usan como disolventes de lacas, resinas, barnices, plásticos, como anticongelantes y en la formación de los esteres correspondientes. El 2-metil-2-propanol se utiliza como antidetonante para la gasolina y aditivo anticongelante.
2.- Alcoholes amílicos.
Los pentanoles o alcoholes amílicos son líquidos de olores agradables que tienen cada vez mayor demanda comercial. Se obtienen por hidroformilación de butenos seguido de hidrogenación.
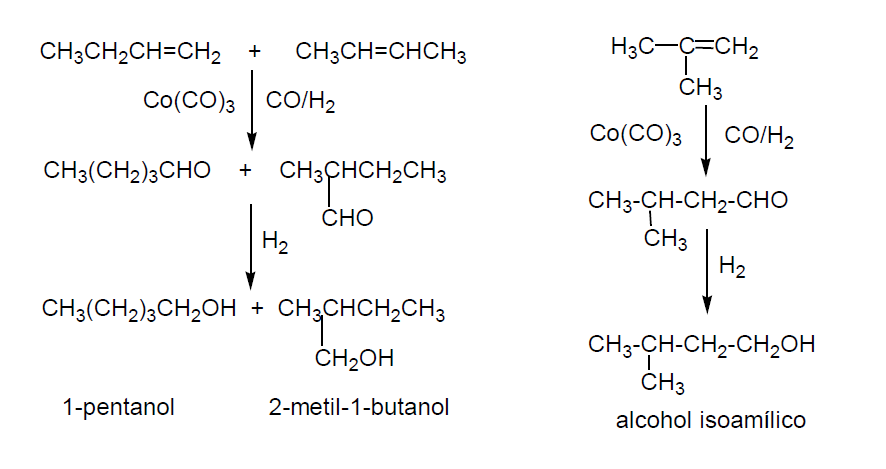
La mezcla de alcoholes amílicos se usa como cosolvente de grasas, aceites y resinas sintéticas. Sus esteres se usan como perfumes y también como disolventes.
3.- Alcoholes superiores.
Los alcoholes superiores de 6 a 18 átomos de carbono, tanto primarios como secundarios, lineales y ramificados tienen una gran importancia industrial. A los alcoholes C6-C11 (o hasta C13) se les denomina alcoholes plastificantes y, generalmente se usan esterificados con ácidos carboxílicos. Los alcoholes de C12-C18 se llaman alcoholes detergentes por sus aplicaciones como tensoactivos en forma de sulfatos o sulfonatos. Los procesos industriales más importantes para obtener estos alcoholes son:
3.1. Alcoholes plastificantes.
A) Hidroformilación de olefinas
Los alquenos C6-C11 por hidroformilación dan lugar a mezclas de aldehídos, de cadena lineal e isoaldehídos, con un átomo de carbono más que el producto de partida, C7-C12. La posterior hidrogenación da lugar a los correspondientes alcoholes primarios lineales y ramificados (isoalcoholes) (tema 4).
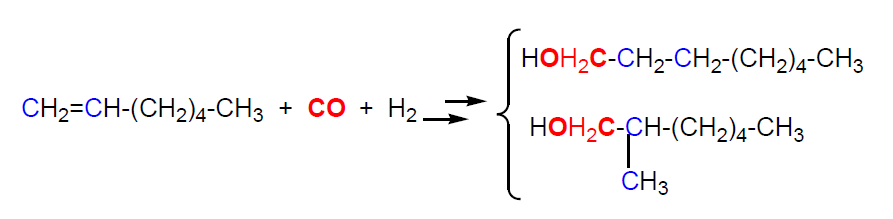
B) Condensación aldólica de butanal
Otra alternativa consiste en realizar la condensación aldólica de estos aldehídos, seguido de hidrogenación catalítica, lo que da lugar a los correspondientes alcoholes con doble número de átomos de carbono que el aldehído de partida. El producto más importante es el 2-Etilhexanol que se obtiene por condensación aldólica de butanal.
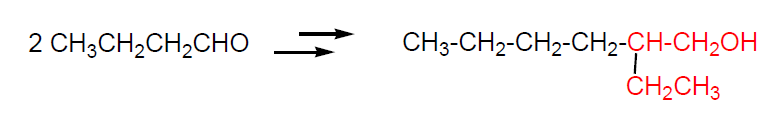
Los alcoholes ramificados así obtenidos se esterifican con diácidos carboxílicos para obtener los diesteres que se usan como plastificantes.
3.2. Alcoholes detergentes.
La producción mundial de alcoholes detergentes es de unas 3x106 Tm/año de las cuales el 53% son de origen sintético (a partir de los productos petroquímicos) y un 43% se obtienen de productos naturales (grasa y aceites).
A) Hidrogenación catalítica de los ácidos grasos
Los alcoholes obtenidos de los triglicéridos naturales son alcoholes primarios de cadena lineal y de número par de átomos de carbono. Su procedimiento de obtención queda resumido en el siguiente esquema.
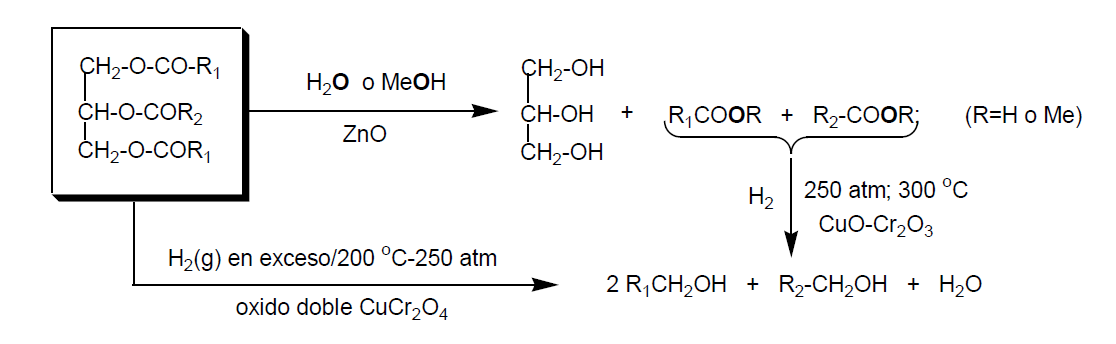
Se transforman en los sulfatos de sodio correspondientes y se utilizan como tensoactivos.
B) Oxidación parcial de n-parafinas a alcoholes
La industria lleva a cabo la oxidación de n-parafinas, procedentes de fracciones de queroseno (C10-C15), con objeto de obtener alcoholes secundarios de cadena lineal. Se someten a un proceso de oxidación con aire en presencia de KMnO4 (0,1%) y ácido bórico (H3BO3). El ácido bórico transforma los hidroperóxidos intermedios en esteres borónicos, más estables, que no dan lugar a roturas de cadena. La reacción se lleva a cabo a presión atmosférica y entre 140-190 °C. La conversión se limita al 20% para evitar reacciones laterales. Las parafinas que no han reaccionado se separan por destilación de los esteres de boro y se introducen de nuevo en el reactor. La selectividad es del 70% ya que se forman un 20% de cetonas y un 10% de ácidos carboxílicos. Del total de alcoholes producidos en este proceso el 98% son alcoholes secundarios. Estos alcoholes se transforman en los correspondientes tensoactivos aniónicos para su uso como detergentes.

C) Obtención de alcoholes por el proceso Alfol
El proceso Alfol es el método industrial más importante para obtener alcoholes de cadena lineal y de un número par de átomos de carbono. Como materia prima se utiliza etileno y trietilaluminio como catalizador. El proceso se realiza en varias etapas:
- PREPARACIÓN DEL CATALIZADOR: En una primera fase se obtiene el catalizador según la siguiente reacción:
- POLIMERIZACIÓN: Sobre este compuesto se polimeriza el etileno a 120 ºC y 100-140 atm y se construye la cadena hidrocarbonada. A este proceso se le da el nombre de reacción de inserción:
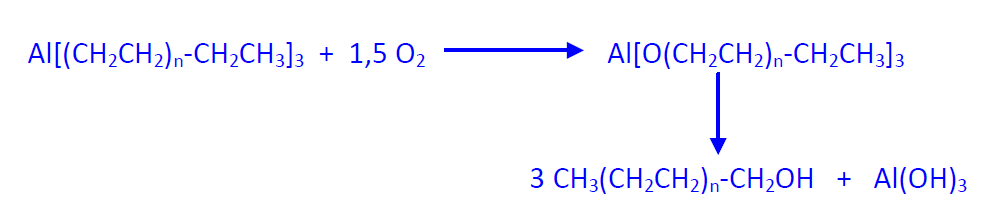
- OXIDACIÓN: Los compuestos de trialquilaluminio se transforman en alcoholes en dos etapas consecutivas, oxidación e hidrólisis. La oxidación se realiza con aire seco a 100 ºC. Los alcóxidos resultantes por posterior hidrólisis con sulfúrico diluido, o sólo con agua, se transforman en los alcoholes correspondientes de 4 a 20 átomos de carbono. La mezcla de alcoholes se separa por destilación fraccionada y los alcoholes se consumen para fabricar detergentes (tema 10). La selectividad del proceso alcanza el 90%. El hidróxido de aluminio se transforma en alúmina que se utiliza como soporte para catalizadores. En la hidrólisis con ácido sulfúrico se obtiene Al2(SO4)3.
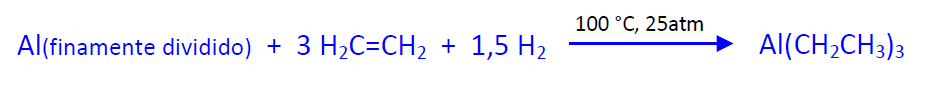

Durante este proceso se forman pequeñas cantidades de (-olefinas que se separan de los compuestos de trialquilaluminio antes del siguiente paso.
La distribución de cadenas obtenida por este procedimiento es muy amplia. Por ello algunas empresas realizan una reacción de transalquilación a continuación de la etapa de inserción. Consiste en tratar los compuestos de trialquilalumnio con (-olefinas C12-C16 a elevadas temperaturas (250 °C) y presiones (35 atm) hasta alcanzar el equilibrio. Por este procedimiento se consigue una distribución más ajustada de productos de reacción, siendo los compuestos mayoritarios los que tienen una longitud de cadena C12-C14.
| nº átomos C | Proceso básico | Transalquilación |
| 6 | 10 | 1 |
| 8 | 17 | 3 |
| 10 | 21 | 8 |
| 12 | 19 | 35 |
| 14 | 15 | 26 |
| 16 | 10 | 17 |
| 18 | 5 | 9 |
| 20 | 3 | 1 |
4.- Otros alcoholes.
- glicerina.
- etilénglicol.
- pentaeritritol (260.000 Tm/año): C(CH2OH)5. Es un sólido de Tf = 262 ºC, soluble en agua en todas proporciones. Se utiliza:
- para resinas alquídicas por polimerización con ácidos o anhídridos (90%)
- para fabricar lubricantes para reactores de aviación
- como explosivo en forma de tetranitrato para construir túneles y carreteras (se mezcla con TNT); C(CH2ONO2)4.